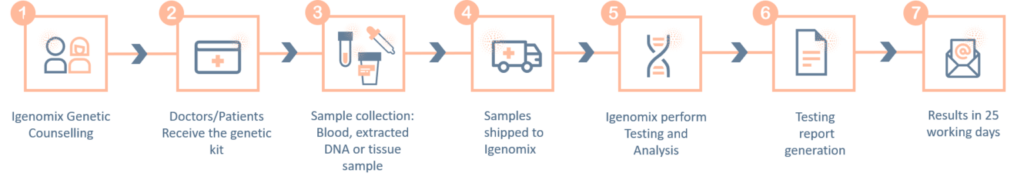
Panel de precisión del síndrome de Kallmann
El síndrome de Kallmann (SK) es un trastorno genético poco común que pertenece al espectro del hipogonadismo hipogonadotrópico aislado. Esta disminución de la función gonadal se debe a una falla en la diferenciación o migración de neuronas que surgen embriológicamente en la mucosa olfatoria y viajan al hipotálamo.