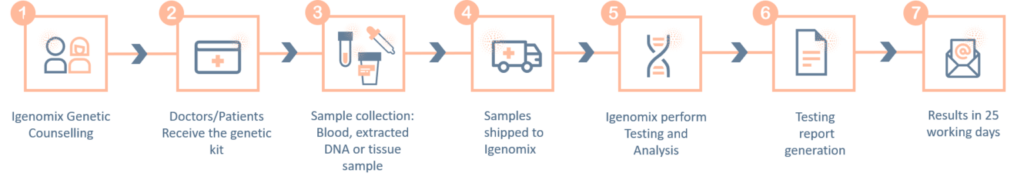
Panel de precisión de muerte cardíaca súbita
La muerte cardíaca súbita (SCD) es una muerte inesperada debido a causas cardíacas que se produce en un período corto de tiempo en una persona con una enfermedad cardíaca subyacente conocida o desconocida.